magazine_ Article
Wenn das Herz plötzlich stillsteht
Eine auch bei jungen Menschen häufig auftretende spezielle Herzerkrankung wird auf Zellebene erforscht
Ein junger Athlet bricht plötzlich mitten auf dem Sportplatz zusammen. Die Rettungskräfte können ihn nicht mehr ins Leben zurückholen und nur mehr seinen Tod feststellen, Diagnose: Herzstillstand. Fälle wie dieser werden immer wieder bekannt und werfen die Frage auf, wie es so unvermittelt dazu kommen konnte. Einer der häufigsten Gründe für den plötzlichen Herztod bei jungen Menschen ist die Hypertrophe Kardiomyopathie, eine angeborene genetische Erkrankung, die einen von 500 betrifft. Die ihr zugrunde liegenden Mechanismen werden im Projekt HYPER-FIBRO untersucht.
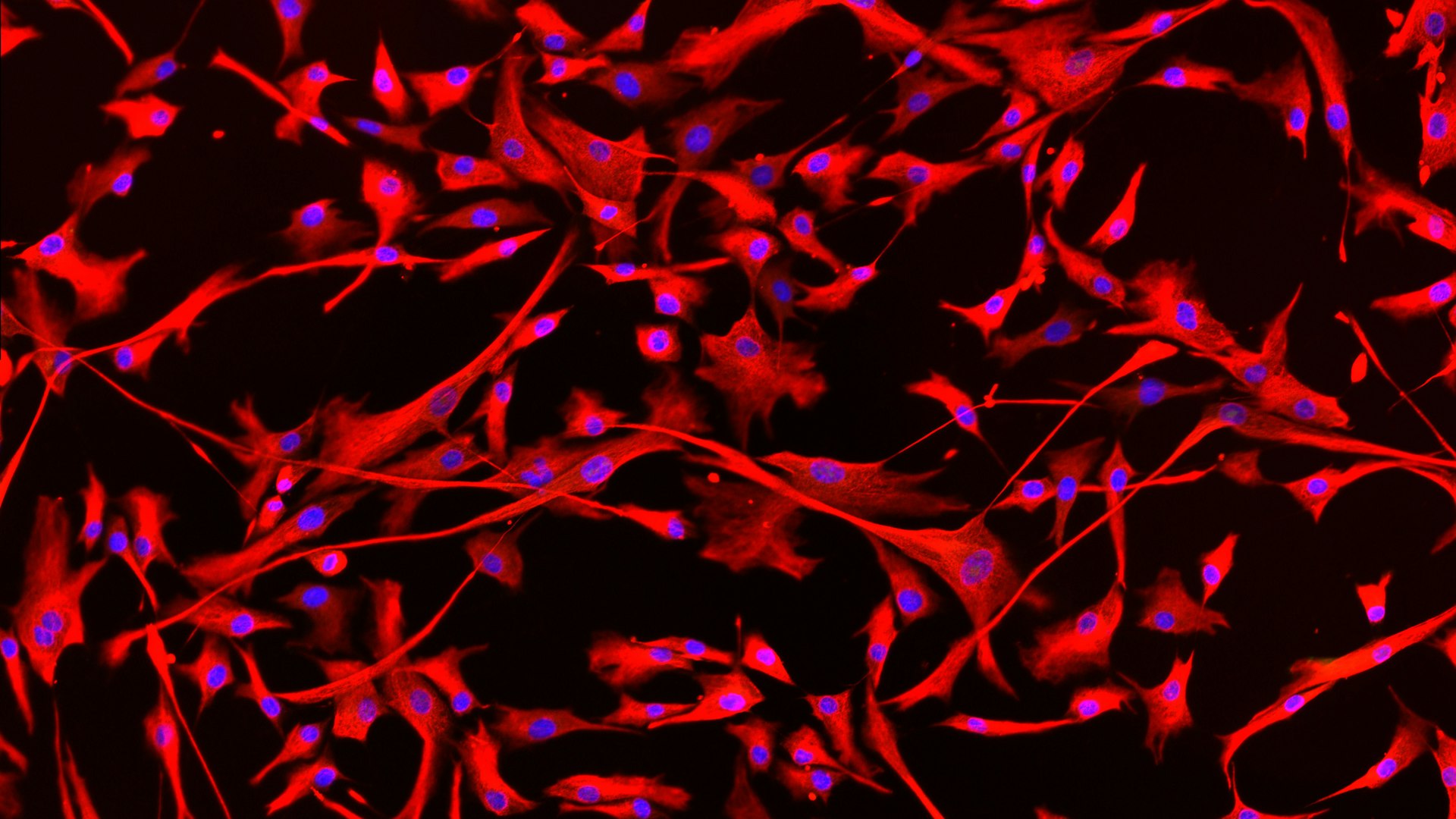
Am Institut für Biomedizin von Eurac Research erforscht die Molekularbiologin Maja Schlittler, wie sich Herzzellen von Patienten mit der Herzkrankheit Hypertrophe Kardiomyopathie (HKM) verhalten. „Kardiomyopathie“ bedeutet eine krankhafte Veränderung der Herzmuskulatur und „hypertroph“ steht für ein übermäßiges Wachstum der Zellen. Bei einem Auftreten der Krankheit wachsen die Herzmuskelzellen auf unkontrollierte Weise, wodurch sich die Herzwand zusehends verdickt. Dazu kommt, dass das Herz einen Überschuss an Narbengewebe – in der Fachsprache „Fibrose“ – bildet. Zellen, die fibrotisches Gewebe produzieren, werden als Fibroblasten bezeichnet. „Bisher wurde die Rolle der Fibroblasten bei der Entstehung von Hypertropher Kardiomyopathie noch nicht untersucht, obwohl eine übermäßige Fibrose eine mögliche Ursache für bösartige Herzrhythmusstörungen ist“, erklärt Schlittler. „Normalerweise bilden Bindegewebszellen ein Netz, das die Struktur des Herzens unterstützt. Bei einer Verletzung im Herzen wandern die Bindegewebszellen dorthin und ‚flicken‘ es, bilden also das Narbengewebe“, erläutert Schlittler. „Es kann bei Erkrankten allerdings vorkommen, dass die Bindegewebszellen sehr stark aktiviert werden und das Narbengewebe zu dick wird.“ Diese Verdickung kann zu Störungen des Herzschlags führen: Das elektrische Signal wird nicht mehr richtig weitergeleitet, und da die Herzwand zu dick ist, kann es zu Problemen beim Ausstoßen des Blutes kommen. Im Laufe der Erkrankung kann es zu Luftnot und Herzrhythmusstörungen, schlimmstenfalls zum plötzlichen Herztod kommen.
Reicht eine medikamentöse Behandlung nicht, um das krankhafte Wachstum der Herzzellen zuverlässig zu stoppen, wird das überschüssige Gewebe am Herzen operativ entfernt. Maja Schlittler arbeitet mit kleinen Proben aus diesem entfernten Gewebe der Patienten. Die Proben bekommt sie von der Universität Florenz, dank der Zusammenarbeit mit dem Forschungsteam der Pharmakologie-Professorin Elisabetta Cerbai. Aus den kleinen Fragmenten „züchtet“ und vermehrt Schlittler im Labor Fibroblasten, welche sie dann durch bestimmte Stimuli manipuliert und beobachtet. Im Forschungsprojekt HYPER-FIBRO will sie verstehen, warum bei HKM-Erkrankten zu viele Fibroblasten produziert werden und wie bestimmte Wirkstoffe sich auf ihr Wachstum auswirken.
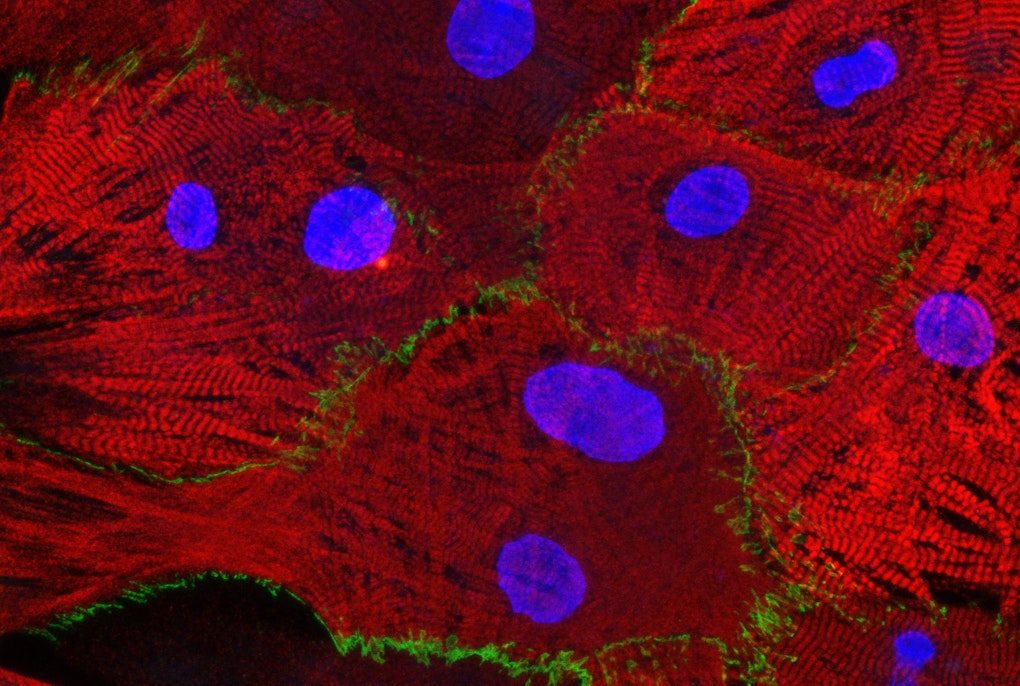
Dafür hat Schlittler anhand der Gewebeproben von fünf HKM-Patienten verschiedene Eigenschaften der Fibroblasten untersucht: ihre Größe, ihre Form und ihre Fähigkeit, sich zu vermehren und sich in der Kulturschale zu bewegen. Außerdem fügte sie den Zellen einen Fluoreszenzmarker hinzu, um genau sehen zu können, welche der Zellen aktiv sind und tatsächlich Narbengewebe bilden.
Der nächste Schritt besteht nun darin, die molekularen Mechanismen innerhalb der Zellen genauer zu untersuchen, um besser zu verstehen, warum die Herzfibroblasten von HKM-Patienten im Vergleich zu gesunden Herzfibroblasten so viel Narbengewebe bilden. Außerdem wird das von den Zellen produzierte fibrotische Gewebe analysiert.
Mit den Erkenntnissen hofft Schlittler eine Grundlage für neue Therapieansätze für die hypertrophe Kardiomyopathie liefern zu können. „Unsere Ergebnissen fließen in die internationale biomedizinische Forschung mit ein und werden dazu beitragen, die Ursachen dieser Herzkrankheit besser zu verstehen und auch zu verstehen, mit welchen Wirkstoffen sie therapiert werden könnte“, so Schlittler.
Das Projekt wurde von der Autonomen Provinz Bozen im Rahmen der Förderung der internationalen Mobilität von Forscherninnen und Forschern finanziert.
Zur Person
Maja Schlittler ist in der Schweiz aufgewachsen. Nach dem Studium an der ETH Zürich arbeitete sie im Bereich der klinischen Forschung in der Schweiz und in Australien. Sie promovierte am Karolinska Institutet in Stockholm zum Thema „Molecular adaptations of skeletal muscle in health and disease“. Seit 2020 ist sie in der Forschungsgruppe “Biology of Cardiac Health and Disease” unter der Leitung von Alessandra Rossini am Institut für Biomedizin von Eurac Research tätig.