La quotidianità in corsia è fatta di esami e interventi chirurgici i cui dati arricchiscono le statistiche per la ricerca. Il futuro della medicina si costruisce in laboratorio, grazie alle cellule staminali e agli studi epidemiologici. Quanto sappiamo oggi sulle aritmie? Come si curano? A che punto è la ricerca? Lo raccontano un cardiologo e una ricercatrice.
- Quali sono le malattie del cuore più diffuse e che posto occupano le aritmie?
- Cosa è un’aritmia?
- Cosa provoca l’aritmia?
- Le aritmie sono pericolose?
- Come si manifestano le aritmie patologiche?
- Come si possono diagnosticare le aritmie se spesso non hanno sintomi?
- Una volta diagnosticate, come si curano le aritmie?
- Ricerca di base sulle cardiopatie genetiche
- Studio CHRIS e fibrillazione atriale
- Ricerca genetica per individuare i pazienti più adatti ai quali impiantare un defibrillatore interno
- Si può fare ricerca di alto livello anche in una provincia di periferia?
Contents
Scarica il dossier aritmie in formato PDF.
© Adobe Stock/sciencerfvideo
Quali sono le malattie del cuore più diffuse e che posto occupano le aritmie?
Le più diffuse sono le malattie ischemiche, che si manifestano quando il sangue fatica ad arrivare al cuore o non arriva proprio. L’esempio più grave è l’infarto. In Italia, circa nove decessi su cento sono dovuti alle malattie ischemiche e in Alto Adige i dati sono in linea. Le aritmie che potrebbero diventare pericolose interessano solo una percentuale minore della popolazione, ma non per questo vanno sottovalutate. Anzi, poiché sono più frequenti tra gli anziani, i medici stimano che in futuro saranno sempre più diffuse. Inoltre, alcune forme, per quanto rare, sono gravi e possono portare a morte improvvisa. Si stima che in Alto Adige, nel 2021, 3.285 4.222 persone abbiano sperimentato un nuovo evento aritmico con conseguente accesso al pronto soccorso o ricovero.
Cosa è un’aritmia?
Un’aritmia è una alterazione del ritmo cardiaco: il cuore batte in modo irregolare, troppo veloce o troppo lento. Il cuore è tenuto in movimento da un impianto elettrico come quello di un’auto, e come in un’auto, possono esserci dei guasti. Per esempio, può esserci un problema alla batteria, che nel cuore corrisponde al nodo senoatriale. Oppure può esserci un problema ai cavi di collegamento, e allora l’impulso elettrico fa contrarre in modo anomalo atri e ventricoli. Quando il cuore batte meno di 50 volte in un minuto si parla di bradicardia; quando i battiti al minuto sono più di 100 si parla di tachicardia. Queste soglie sono però solo indicative: ogni situazione va contestualizzata. Per esempio, **alcuni hanno un “cuore d’atleta”, cioè un cuore che batte più lento del normale, ma non hanno problemi. Anzi, poiché vanno meno in affanno, le loro prestazioni atletiche di resistenza sono spesso migliori; il ciclista Fausto Coppi aveva in media 35 battiti al minuto a riposo. Sono aritmie anche le extrasistoli, cioè battiti supplementari, che sono molto diffusi e di norma benigni.

Cosa provoca l’aritmia?
Ci sono almeno 30 diversi tipi di aritmia con caratteristiche diverse. Le cause possono essere cardiache, ma anche di altra origine, per esempio stress, abuso di sostanze eccitanti come caffè e droghe, disfunzioni della tiroide. In alcuni casi, le aritmie compaiono in modo spontaneo e sono più frequenti nelle persone anziane e in chi ha già altri problemi come la pressione alta o è in sovrappeso. In altri casi sono una conseguenza di infarti, perché, per esempio, si sono formate delle piccole cicatrici sul cuore che interrompono la propagazione normale dell’impulso elettrico. In altri casi ancora hanno cause genetiche (aritmie congenite) e vengono trasmesse dai genitori. Sono i casi più rari, ma talvolta i più gravi.
Le aritmie sono pericolose?
Nella maggior parte dei casi piccole alterazioni del ritmo sono normali e occasionali. Quando riposiamo è normale che il cuore rallenti; per contro, quando facciamo attività fisica o quando siamo agitati per un evento speciale è normale che il ritmo acceleri. Anche le extrasistoli, nel 99 per cento dei casi non devono spaventare. Diverso è il discorso per le aritmie patologiche, che possono essere più o meno severe. I cardiologi ne distinguono due tipi: le aritmie sopraventricolari, che hanno origine negli atri, e quelle ventricolari, che hanno origine nei ventricoli.
Come si manifestano le aritmie patologiche?
Ci sono aritmie che si manifestano e altre che non danno sintomi.
ARITMIE CON SINTOMI
Alcuni pazienti sperimentano crisi molto intense: il cuore si mette a battere all’improvviso fino a 200 volte al minuto e questo dura da pochi minuti fino anche a più di venti minuti. Le vittime non possono non accorgersene: sentono batticuore, tremano, sudano, in alcuni casi perdono conoscenza e quasi sempre devono recarsi al pronto soccorso. I pazienti che sanno di soffrire di aritmie devono imparare a convivere con l’ansia – quando arriverà, se arriverà, la prossima crisi? – ma possono tenere monitorata la malattia e intervenire al bisogno.
ARITMIE SENZA SINTOMI
I rischi maggiori, li corrono le persone che non sanno di soffrire di aritmie. Se l’aritmia non dà sintomi, si può arrivare alle estreme conseguenze (arresto cardiaco o ictus) senza che i pazienti abbiano avuto avvisaglie. Purtroppo, questo succede spesso con le aritmie congenite, che spesso dipendono da cardiopatie causate da geni mutati. Queste malattie su base genetica sono rare, ma in alcuni portatori di anomalie genetiche possono manifestarsi in forme molto gravi. Per esempio, la sindrome del QT lungo, la sindrome di Brugada, la tachicardia ventricolare polimorfa catecolaminergica o la cardiomiopatia aritmogena (chiamata anche displasia aritmogena).
Come si possono diagnosticare le aritmie se spesso non hanno sintomi?
Non è facile. Oltre al fatto che alcune aritmie non si manifestano con sintomi chiari, alcune forme non si riconoscono durante un controllo singolo, serve un monitoraggio sul lungo periodo perché queste crisi sono – per l’appunto – irregolari.
Ecco i principali strumenti di controllo e diagnosi:
| ESAME | QUANDO SI FA | PERCHÉ É UTILE |
|---|---|---|
| Visita medico-sportiva con elettrocardiogramma (ECG) | Obbligatoria a partire dai 12 anni se si vuole praticare una attività sportiva. Ha in qualche modo sostituito la visita di leva che un tempo era l’occasione per controllare tutta la popolazione maschile. | Scopre le aritmie più evidenti, e alcune aritmie congenite, come la sindrome del QT lungo. |
| Elettrocardiogramma neonatale | Solo nei casi di familiarità di malattie genetiche note. Per i cardiologi sarebbe utile sottoporre tutti i neonati a ECG. | Individua aritmie evidenti, anche se in famiglia non ci sono stati segnali espliciti fino a quel momento. |
| Visita cardiologica preventiva con elettrocardiogramma | Fortemente consigliata una volta all’anno dopo i 65/70 anni. | Nella terza età aumentano i fattori di rischio, come l’ipertensione. |
| Apparecchi per la misurazione della pressione sanguigna con integrato un misuratore di aritmie | Consigliato dopo i 65/70 anni. | Oltre a controllare i parametri della pressione, le persone più anziane possono sorvegliare eventuali aritmie e comunicarle al medico. |
| Holter: elettrocardiogramma prolungato, fino a 24/36 ore | Quando i medici sospettano un’aritmia, ma non riescono a intercettarla con un ECG puntuale e l’aritmia si verifica quasi quotidianamente. | Scopre aritmie, anche lievi, per esempio durante la notte. |
| Loop-recorder: misuratori che vengono posizionati sul petto del paziente, o anche impiantati sottocute, e registrano il ritmo del cuore per un periodo che può arrivare fino a tre anni | Quando i medici sospettano un’aritmia, ma non riescono a intercettarla con un ECG puntuale e l’aritmia si presenta in modo sporadico. | Scopre aritmie, anche lievi e sporadiche, per esempio durante la notte. |
| App per smartphone o smart watch che registrano gli episodi di aritmia, intensità e durata, e inviano i dati via GPS | Quando un’aritmia è nota e se ne vuole controllare l’andamento. | Utile specialmente nei casi di tachicardie parossistiche, che si presentano in mondo improvviso e sono molto intense. Bisogna stare attenti ai frequenti falsi positivi, per esempio in caso di sforzi sportivi. |
| Ecocardiografia + risonanza magnetica che permettono di analizzare la morfologia del cuore | Per approfondire la diagnosi. | Scoprono aritmie dovute ad alterazioni nella struttura del cuore, per esempio la cardiomiopatia aritmogena. In questo caso, il cuore dei pazienti che ne soffre si riempie di grasso. |
| Test genetici | I medici li prescrivono quando ci sono casi noti in famiglia di aritmie congenite o quando hanno escluso altre cause | Escludono o individuano eventuali mutazioni dei geni. Chi ha una mutazione potrebbe sviluppare la malattia e sapendolo può sottoporsi a una prevenzione specifica. |
Una volta diagnosticate, come si curano le aritmie?
Prima di tutto i medici devono individuare il tipo di aritmia e quali siano le cause specifiche. I medici possono:
- Eliminare o contenere i fattori di rischio, che variano da aritmia ad aritmia. Per esempio, il peggiore fattore di rischio per la fibrillazione atriale è l’ipertensione. Chi soffre di sindrome del QT lungo deve mantenere i valori del potassio nel sangue a livelli che per le altre persone sono eccessivi. Chi soffre di cardiomiopatia aritmogena deve assolutamente evitare lo sport, che invece fa bene a chi è sovrappeso e soffre di fibrillazione atriale.
- Prescrivere farmaci che regolarizzino il battito.
- Intervenire con una piccola ablazione, cioè si cauterizza il pezzettino di cuore responsabile dell’aritmia. Nell’Ospedale di Bolzano i medici aritmologi effettuano circa 200 ablazioni all’anno, più o meno una ogni due giorni.
- Impiantare un pacemaker. Quando il cuore, e nello specifico il nodo senoatriale, non riesce più a darsi un ritmo da solo, si sostituisce la centralina elettrica con una artificiale. In Alto Adige se ne impiantano circa 300 all’anno, quasi una al giorno.
- Impiantare un defibrillatore interno, che interviene in modo automatico in caso di arresto. In Alto Adige se ne impiantano circa 100 all’anno.
- Indicare una terapia genetica. Gli studi sono ancora pionieristici, ma ci sono alcune prospettive. Per esempio,una équipe dell’Istituto Maugeri di Pavia lavora a una cura genetica per la tachicardia ventricolare polimorfa catecolaminergica.
- Partecipare e sostenere la ricerca. Per quanto riguarda la ricerca clinica, i medici dell’Ospedale di Bolzano condividono, in forma anonima, i dati dei loro casi in una rete nazionale. In questo modo la massa critica di informazioni che arrivano da più ospedali permette valutazioni statistiche più robuste.Per quanto riguarda la ricerca di base, ci sono alcuni studi in corso assieme ai ricercatori di Eurac Research
In Eurac Research stiamo svolgendo vari studi sulle aritmie.
Ricerca di base sulle cardiopatie genetiche
La cardiomiopatia aritmogena è una malattia genetica del cuore: rara e molto grave. Nel cuore di chi ne soffre le cellule vengono via via soffocate da accumuli di grasso e di tessuto fibroso. Questo può causare aritmie maligne che portano a morte improvvisa. Purtroppo, a volte, non ci sono avvisaglie e la morte improvvisa è il primo sintomo con cui si manifesta la malattia. **La cardiomiopatia aritmogena è nota per aver ucciso atleti in giovane età come il calciatore del Livorno Piermario Morosini o il giocatore di hockey dell’Asiago Darcy Robinson. Altre volte può succedere che, anche nel caso in cui le aritmie siano individuate e tenute sotto controllo, l’accumulo fibro-adiposo sia tale da impedire al cuore di pompare il sangue in modo adeguato. Si parla allora di insufficienza cardiaca e, seppure in rari casi, l’alternativa può essere solo il trapianto d’organo.
Si può contrastare questo processo? È quello che sperano le ricercatrici di Eurac Research che stanno riproducendo il processo in laboratorio.
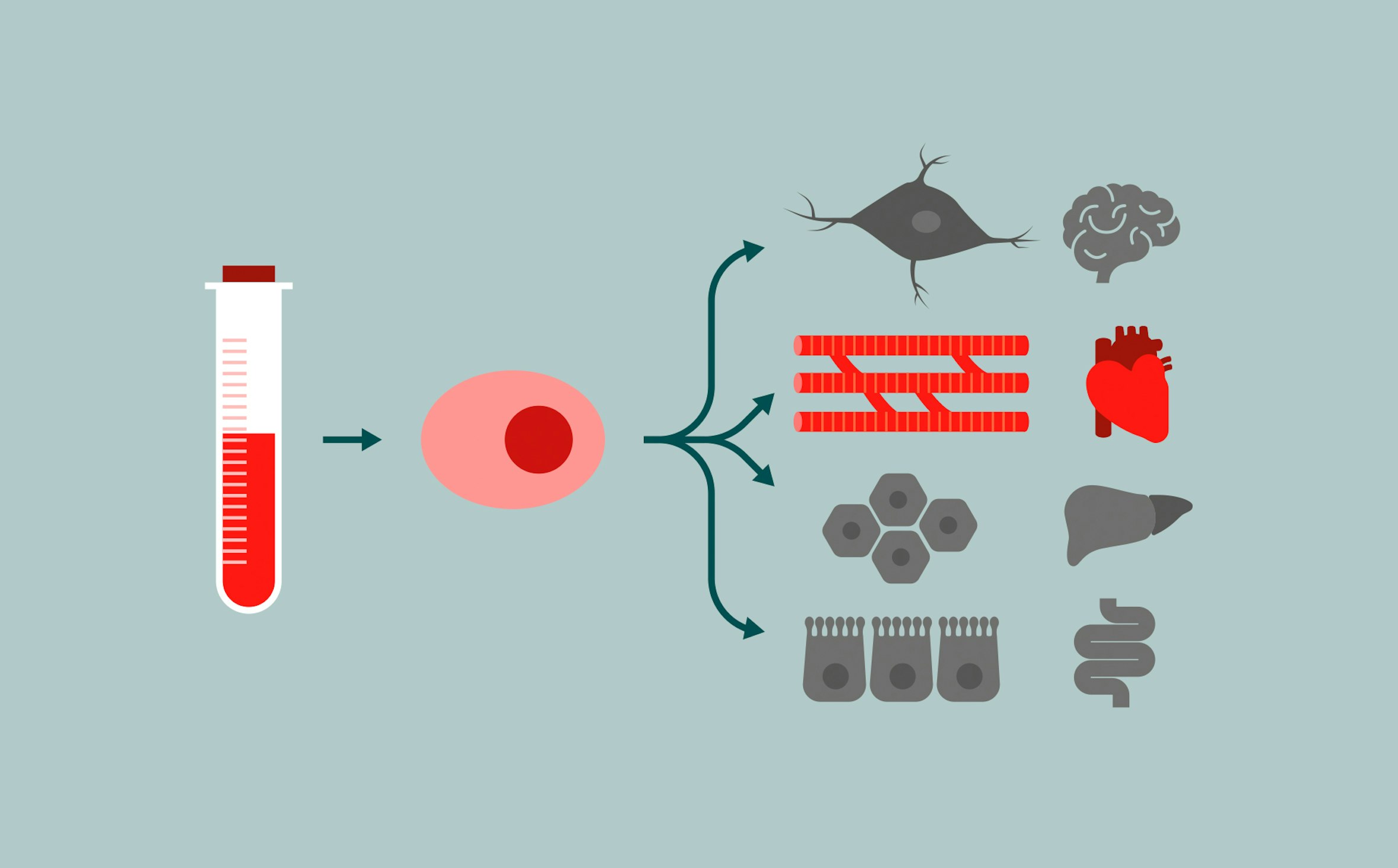
In particolare, usano cellule staminali pluripotenti indotte. Cioè prelevano cellule dal sangue di pazienti ammalati di cardiomiopatia aritmogena, le riprogrammano per renderle “neutre” (staminali) e, successivamente, le riprogrammano per diventare cellule del cuore (cardiomiociti). A quel punto osservano cosa succede al loro interno e le confrontano con cardiomiociti sani per capire dove il sistema si inceppa.
Inoltre, grazie anche al supporto del Provincial Joint Programme – IT-FWF e in collaborazione con l’Università di Innsbruck (MUI), il Centro cardiologico Monzino e l’Università statale di Milano abbiamo dimostrato che, usando un inibitore dell’attività dell’enzima GCN5, si può rallentare la formazione degli accumuli adiposi, tipici della malattia, in cellule chiamate fibroblasti cardiaci. Ulteriori studi saranno necessari per capire se questo farmaco possa funzionare non solo su cellule isolate, ma sui pazienti colpiti dalla malattia.
Sembra semplice, ma i tempi della ricerca di base sono molto lunghi, durano anni. Per esempio, solo per ottenere cellule staminalipluripotenti indotte dalle cellule del sangue di donatori occorrono all’incirca sei mesi. Successivamente, ogni volta che si vogliono ottenere i cardiomiociti servono tra i 30 e i 60 giorni. Questo processo va ripetuto molte volte per avere risultati rilevanti e significativi. Del resto, comprendere meglio cosa succede nelle cellule malate è l’unica via per capire dove si potrebbe intervenire per rallentare o interrompere il processo della malattia. Questi studi sono possibili grazie alla collaborazione con la Cardiologia dell’Ospedale di Bolzano e grazie alla generosità di famiglie dell’Alto Adige con questa patologia che hanno accettato di partecipare allo studio donando campioni del loro sangue.
 © Eurac Research | Oscar Diodoro
© Eurac Research | Oscar DiodoroStudio CHRIS e fibrillazione atriale
La forma più diffusa di aritmia è la fibrillazione atriale. In Italia circa l’1 per cento della popolazione ne soffre e la percentuale può salire fino al 10 per cento sopra gli 80 anni. In Alto Adige gli ammalati noti sono circa 3.000, cioè circa sei persone ogni 1.000; questi dati sono in linea con i dati nazionali, tenuto conto che si tratta dei soli casi accertati tramite ricovero in ospedale o accesso al pronto soccorso. Il 30 per cento delle persone che ha una fibrillazione atriale non sa però di averla e non è in cura, quindi non figura in queste statistiche. Per questo motivo, gli studi epidemiologici, che raccolgono dati da tutta la popolazione, hanno numeri di norma più alti perché durante gli screening emergono casi che non erano noti prima. È successo anche con CHRIS, lo studio epidemiologico sulla salute dell’Alto Adige di Eurac Research e Azienda sanitaria. 114 partecipanti su circa 10.500 – cioè circa l’1 per cento, in linea con i dati nazionali – avevano già ricevuto una diagnosi di fibrillazione atriale. In aggiunta a questi, 60 partecipanti sono stati indirizzati a svolgere verifiche più approfondite dopo che lo studio ha messo in luce delle anomalie che fanno sospettare una fibrillazione atriale.
Il gruppo di ricerca di Eurac Research, sempre in collaborazione con l’Azienda sanitaria, ha analizzato i dati genetici e alcuni prodotti del metabolismo presenti nel sangue dei partecipanti dello studio CHRIS per investigare le cause della manifestazione della fibrillazione atriale. Questo studio, pubblicato nel 2021, ha creato nuove conoscenze sulla malattia, individuando nei pazienti con fibrillazione atriale l’associazione tra due varianti genetiche rare e bassi livelli di uno specifico lipide nel sangue.
Ricerca genetica per individuare i pazienti più adatti ai quali impiantare un defibrillatore interno
Ad alcuni pazienti a rischio di sviluppare aritmie ventricolari fatali viene impiantato un defibrillatore interno, programmato per dare uno shock elettrico se il cuore va in fibrillazione ventricolare. Secondo i dati però questo dispositivo è utile solo nel 30 per cento dei pazienti a cui viene impiantato in prevenzione primaria (cioè pazienti che non hanno finora avuto arresti). Questo non sarebbe un grande problema se l’impianto non avesse costi elevati (il modello base costa circa 6.000 euro) e non ci fosse il rischio di complicazioni significative, come infezioni o shock inappropriati. Nello shock inappropriato il defibrillatore dà erroneamente una scarica quando non è necessario, e questa scarica, che si verifica quando il paziente è cosciente, è dolorosa e traumatica. Si potrebbe risparmiare l’impianto ad alcuni pazienti? Come capire quali sono i pazienti più adatti? C’entra il loro DNA? È quello che cercano di capire i genetisti di Eurac Research e i medici del reparto di Cardiologia degli Ospedali di Bolzano e Trento. Per tre anni, i ricercatori hanno monitorato un campione di 286 pazienti con impiantato un defibrillatore interno: hanno incrociato i dati sui profili genetici e i dati sugli interventi del defibrillatore che hanno scongiurato un arresto cardiaco. Ne è risultato che **gli interventi appropriati sono più frequenti nei pazienti con alcune caratteristiche (varianti) del DNA. Questi pazienti potrebbero essere più soggetti ad aritmie potenzialmente pericolose. Ora i ricercatori stanno confrontando i loro risultati con quelli di un team di ricerca nell’Iowa, Usa. Se le loro ipotesi saranno confermate, i risultati potrebbero aiutare i medici ad aggiornare le linee guida per scegliere i pazienti più predisposti a sviluppare aritmie e quindi più bisognosi del defibrillatore.
Si può fare ricerca di alto livello anche in una provincia di periferia?
Si può e si deve. Fondamentale è scambiare le informazioni che si ottengono con altri centri di ricerca. Le pubblicazioni sono condivise su portali come Pub Med, dove tutti gli altri ricercatori possono trovarle, e i convegni sono ottime occasioni di confronto. Non solo, i ricercatori trascorrono dei periodi in altri laboratori per acquisire tecniche nuove. Per esempio, il team che in Eurac Research si occupa di ricerca cardiovascolare ha scambi al momento con l’Università di Parma, il Centro cardiologico Monzino di Milano, l'Università medica di Innsbruck, l'International Centre for Genetic Engineering and Biotechnology di Trieste e l'Università per le Scienze applicate della Carinzia (CUAS).. Ha inoltre vinto borse di studio dalla Fondazione Veronesi e dalla European Molecular Biology Organization (EMBO), è stato supportato da un finanziamento di Fondazione Telethon ed è attualmente supportato da finanziamenti europei e provinciali.
 Science that inspires
Science that inspiresPubblicazioni scientifiche
Una lista delle pubblicazioni scientifiche su questo tema è disponibile nell’Archivio Istituzionale di Bolzano (BIA).
Nel dettaglio, le pubblicazioni dell’autrice Alessandra Rossini sono raggiungibili dal suo profilo ORCID.
Il dossier sulle aritmie è disponibile anche come unità didattica interattiva online
Programma di finanziamento attuale: Joint Project SüdTyrol- FWF (Italy-Austria), grant number 23623; fondo FESR* / Interreg V-A Italy-Austria 2014-2020 grant number ITAT1047 per il progetto INCardio.
Colophon
Alessandra Rossini, ricercatrice dell’Istituto di biomedicina di Eurac Research e Werner Rauhe, cardiologo elettrofisiologo,
già responsabile della struttura semplice “Terapia intensiva cardiologica e reparto” dell’Ospedale di Bolzano.
Supporto scientifico di Marzia De Bortoli, Luisa Foco e Roberto Melotti (Eurac Research), Roberto Cemin (Ospedale di Bolzano), Mirko Bonetti e Carla Melani (Osservatorio per la salute -p.a. di Bolzano).
Redazione: Valentina Bergonzi
Illustrazioni: Oscar Diodoro
Animazione: Fabio Dalvit
Grafica: Alessandra Stefanut