Il Parkinson è una malattia neurodegenerativa più frequente tra gli ultrasessantenni e dunque destinata a essere sempre più diffusa per l’invecchiamento delle società occidentali. Cosa succede nel cervello di chi si ammala? Come si fa la diagnosi e come la si cura? E a che punto sta la ricerca?
- Quante sono le persone ammalate di Parkinson in Alto Adige?
- Chi si ammala di più?
- Personaggi noti ammalati di Parkinson
- Per quale motivo ci si ammala?
- È vero che il fumo protegge dal Parkinson?
- Ci sono fattori ambientali riconosciuti come dannosi?
- Cosa succede nel cervello delle persone malate di Parkinson?
- Di Parkinson si muore?
- Il tremore è il sintomo più conosciuto. Quali sono gli altri?
- Il Parkinson si cura?
- Ci si può vaccinare?
- Quanto è lontana la cura per guarire in modo definitivo?
- Quale potrebbe essere la svolta nella diagnosi?
- La ricerca biomolecolare in Eurac Research
- Le tappe principali della ricerca sul Parkinson
- Quanti fondi vengono investiti nella ricerca sul Parkinson, a livello pubblico e privato?
- Quali sono i centri di riferimento per l’assistenza in Alto Adige?
Contents
Scarica qui il Dossier Parkinson in formato PDF.
Quante sono le persone ammalate di Parkinson in Alto Adige?
Circa 1.500. Il dato è in linea con i numeri internazionali: la malattia di Parkinson infatti colpisce due, tre persone ogni mille, cioè circa lo 0,2 per cento della popolazione totale. I numeri crescono molto con l’età: dopo i 60 anni le persone che si ammalano generalmente sono l’un per cento, e questo dato si conferma anche in Alto Adige. Siccome la malattia è più frequente tra gli anziani, la comunità medica stima che in futuro sarà sempre più diffusa.
Tra le 13.000 persone che hanno partecipato alla prima fase di CHRIS, lo studio sulla salute di Eurac Research e Azienda sanitaria, sono circa 20 quelle malate di Parkinson, in linea con i dati generali.
Le persone che si ammalano dopo i 60 anni
1 su 100
Chi si ammala di più?
Gli uomini si ammalano più delle donne, con una proporzione di 2:1. Nelle varie popolazioni in generale non ci sono differenze, eccezion fatta per alcune popolazioni chiuse in cui giocano un ruolo chiave le forme familiari della malattia. Per esempio, tra gli ebrei aschenaziti in USA o i berberi del nord Africa l’incidenza del Parkinson è eccezionalmente alta, vale a dire che ogni anno si registra un numero eccezionalmente alto di nuovi casi. Anche in Alto Adige vediamo una frequenza della malattia un po' più alta negli uomini.
Gli uomini si ammalano più delle donne, con una proporzione di 2:1.
Per quale motivo ci si ammala?
Le cause che sono all’origine del Parkinson sono ancora sconosciute. Ci sono però vari fattori associati al suo sviluppo, tra cui cause ambientali e fattori genetici. Grazie agli studi genetici degli ultimi vent’anni oggi nel dieci per cento dei casi la malattia viene riconosciuta come forma familiare, cioè si può ricondurre a una specifica mutazione o alterazione genetica. Finora sono stati scoperti circa 20 geni correlati al Parkinson.
La malattia ha cause genetiche una volta su dieci.
Ricerca genetica: il Parkinson in Alto Adige
Per studiare le cause genetiche del Parkinson si osservano le famiglie nelle quali ci sono più malati, generazione dopo generazione. I ricercatori ricostruiscono l’albero genealogico – l’ideale sarebbe avere tre/quattro generazioni – e confrontano il DNA e le caratteristiche del numero più alto possibile di componenti della famiglia. L’obiettivo è trovare la differenza (la mutazione genetica) tra chi si è ammalato e chi no.
Il gruppo di ricerca di Eurac Research ha trovato nei suoi studi svolti su Parkinson famiglie dove ha ricostruito alberi genealogici con più membri affetti da Parkinson,che sono portatori di una mutazione del gene parkina.
Quando una persona eredita sia dal padre sia dalla madre una mutazione di questo gene quasi sicuramente si ammalerà. In particolare, si ammalerà di una forma precoce che si sviluppa spesso prima dei 45 anni. Per fortuna però questa doppia mutazione è rara. Più spesso si eredita solo una mutazione da un solo genitore (mutazioni eterozigoti): in questi casi è molto improbabile che la persona si ammali e se si ammala di solito succede in età anziana e con sintomi molto più lievi.
Lo studio CHRIS ricercatori e ricercatrici offre la possibilità di individuare altri portatori di mutazioni eterozigoti del gene parkina e di studiare perché alcuni presentano sintomi, anche se lievi e altri no. In particolare, la ricerca riguarda le mutazioni nel DNA mitocondriale (ereditato dalla madre), cioè nelle centrali energetiche delle nostre cellule.
È vero che il fumo protegge dal Parkinson?
Gli studi epidemiologici hanno associato il fumo e anche la caffeina a una minore incidenza del Parkinson. Caratteristica di questi studi è fotografare una particolare situazione e condurre un’analisi statistica su ciò che la fotografia mostra. In breve, osservando un certo numero di persone, si contano quante hanno una diagnosi di Parkinson e quante hanno altre caratteristiche, come il fumo. L’analisi statistica mostra che tra i fumatori, il numero di malati di Parkinson è minore. Esiste però una differenza sostanziale tra associazione e rapporto di causalità. Gli studi epidemiologici non osservano nel tempo i fumatori e non registrano quanti svilupperanno la malattia, quindi la causalità non è dimostrata. Dati gli effetti collaterali noti del fumo la comunità medico-scientifica lo sconsiglia decisamente come fattore di protezione.
Ci sono fattori ambientali riconosciuti come dannosi?
Vari studi hanno associato una maggiore incidenza del Parkinson ai pesticidi, ai solventi organici presenti nelle colle e nel petrolio e derivati e a sostanze tossiche come quelle presenti nelle droghe sintetiche.
In Francia, dal 2012, il Parkinson è riconosciuta come malattia professionale tra gli agricoltori.
All’Università di Trento e all’Ospedale Santa Chiara hanno registrato come in val di Non il numero di donne che si ammalano di Parkinson sia insolitamente più alto rispetto ai maschi; molte di queste donne lavorano o avevano lavorato nei capannoni di stoccaggio delle mele. Come per il fumo, non ci sono però rapporti di causa-effetto dimostrati.
Qualche anno fa un gruppo di ricerca canadese ha studiato la popolazione della provincia del Saskatchewan, che vive in aree agricole e ha un numero altissimo di malati. Gli scienziati cercavano un legame chiaro tra la malattia e un particolare pesticida, ma hanno finito con lo scoprire una mutazione genetica caratteristica di quella comunità.
Anche forti colpi alla testa, per esempio su un ring o su un campo da calcio, potrebbero scatenare la malattia.
Cosa succede nel cervello delle persone malate di Parkinson?
Da entrambi i lati del cervello c’è un pezzettino di cervello minuscolo, difficilmente visibile a occhio nudo, chiamato substantia nigra compacta (sostanza nera compatta) per il colore scuro delle cellule neuronali al suo interno. In questa area ci sono dei neuroni che, tramite delle specie di binari (gli assoni) comunicano con altre aree del cervello più distanti. In particolare, i neuroni della substantia nigra comunicano con la parte del cervello che regola i movimenti volontari. Nelle persone malate di Parkinson i neuroni della substantia nigra muoiono progressivamente. A quel punto non comunicano più con le altre parti del cervello e gli ammalati non riescono più a fare i movimenti che vogliono fare – quelli involontari invece sì. Per esempio una persona malata di Parkinson riesce a schivare un oggetto che le si mette davanti mentre cammina: il suo cervello riconosce la presenza di un ostacolo e in modo istintivo le fa alzare la gamba. Se però alla stessa persona cade di mano un oggetto e vuole raccoglierlo non ci riesce. Negli stadi più avanzati il malato è intrappolato nel suo corpo, e non riesce nemmeno più a parlare.
I neuroni della substantia nigra muoiono. Nei neuroni che sopravvivono si formano delle piccole masse chiamate “corpi di Lewy”. © Eurac Research | Fabio Dalvit
Di Parkinson si muore?
L’immaginario collettivo fa pensare che di Parkinson non si muoia, ma il paziente muoia di anzianità. Di certo il Parkinson è una malattia diversa, per esempio, dal cancro, che ha una progressione molto più rapida e una fatalità maggiore e più “evidente”. Ma di Parkinson in realtà si muore: la riduzione nell’aspettativa di vita è significativa, dai quattro agli 11 anni in meno, e, aspetto non trascurabile, è grandissimo l’impatto sulla qualità della vita.
Dai quattro agli 11 anni: tanto si riducono le aspettative di vita dei malati di Parkinson.
Il tremore è il sintomo più conosciuto. Quali sono gli altri?
Nonostante il tremore sia nell’immaginario collettivo il sintomo più legato al Parkinson, non è il principale e nemmeno il più invalidante. I medici fanno una distinzione principale tra sintomi motori e sintomi non motori (che possono comparire fino a 15 anni prima dei sintomi motori).
Il Parkinson si cura?
Purtroppo non esiste una cura nel senso stretto del termine, ossia il blocco del processo patologico e della progressione. Esistono terapie sintomatiche, come il farmaco L-Dopa, che controllano molto bene i sintomi motori. La loro efficacia è però relativamente breve e dopo alcuni anni si riduce, in contemporanea a effetti collaterali importanti. Inoltre non esistono trattamenti specifici per i sintomi non motori e il neurologo deve usare sia terapie con altre indicazioni (per esempio per la depressione) sia metodi complementari (per esempio la fisioterapia) per salvaguardare il più possibile la qualità della vita.
Esistono terapie solo per i sintomi, non per bloccare la malattia.
Ci si può vaccinare?
Al momento no. Ci sono diversi approcci che al momento vengono testati in studi clinici. Uno di questi è dell’azienda austriaca Affiris che ha pubblicato recentemente i primi dati su un vaccino al quale sta lavorando. I risultati della fase I dello studio, durata quattro anni, sarebbero promettenti.
Quanto è lontana la cura per guarire in modo definitivo?
Quando i medici diagnosticano il Parkinson, la malattia di solito ha già fatto molti danni: quando compaiono i primi sintomi almeno il 50 per cento dei neuroni della substantia nigra è già andato perso. Una terapia che guarisca partirebbe già in ritardo, rincorrendo la malattia. Per questo la ricerca si focalizza sui sistemi di diagnosi: riconoscere prima possibile il processo degenerativo dei neuroni e fermarlo.
Quando compaiono i primi sintomi, almeno il 50 per cento dei neuroni della substantia nigra è già andato perso.
Quale potrebbe essere la svolta nella diagnosi?
Al momento la diagnosi è clinica, attraverso test neurologici, ma la conferma si può avere solo con l’autopsia: se la substantia nigra non è più scura significa che i neuroni sono effettivamente morti per il Parkinson. La svolta per la diagnosi sarebbe uno strumento di imaging. La Fondazione Michael J. Fox ha messo in palio due milioni di dollari da investire in ricerca per chi scoprirà un mezzo di contrasto per la PET che evidenzi in modo precoce i segni della malattia nel cervello, prima che compaiano i sintomi più evidenti. A questo bisogna aggiungere la ricerca di base per capire dove cominciano le alterazioni dei processi molecolari che provocano il Parkinson.
La ricerca biomolecolare in Eurac Research
Cosa succede nelle cellule quando ci si ammala di Parkinson? Qual è la successione di eventi? Come sono collegati tra loro? Cosa provocano le mutazioni genetiche? Come si può intervenire? Ricercatrici e ricercatori di biologica, genetica, statistica e chimica farmaceutica dell’Istituto di biomedicina studiano i processi molecolari del Parkinson. Il loro obiettivo è capire dove si potrebbe intervenire per fermare o rallentare la malattia.
Gene parkina e mitocondri
La parkina è uno dei geni riconosciuto responsabile di una forma familiare del Parkinson. Quando è mutato influisce negativamente sui mitocondri, che forniscono energia ai neuroni. E poiché i neuroni hanno bisogno di molta energia per vivere e lavorare, una disfunzione dei mitocondri può contribuire alla loro morte. In particolare, le ricercatrici di Eurac Research hanno scoperto una proteina mitocondriale che interagisce con la parkina: la proteina SLP-2. Si può ristabilire il funzionamento dei mitocondri – e salvare così i neuroni – con una terapia che lavori sulla proteina SLP-2? Le ricercatrici lo stanno verificando aumentando l’espressione di SLP-2 in diversi modelli cellulari. I primi risultati sono positivi.
Per queste ricerche usiamo le cellule staminali pluripotenti indotte
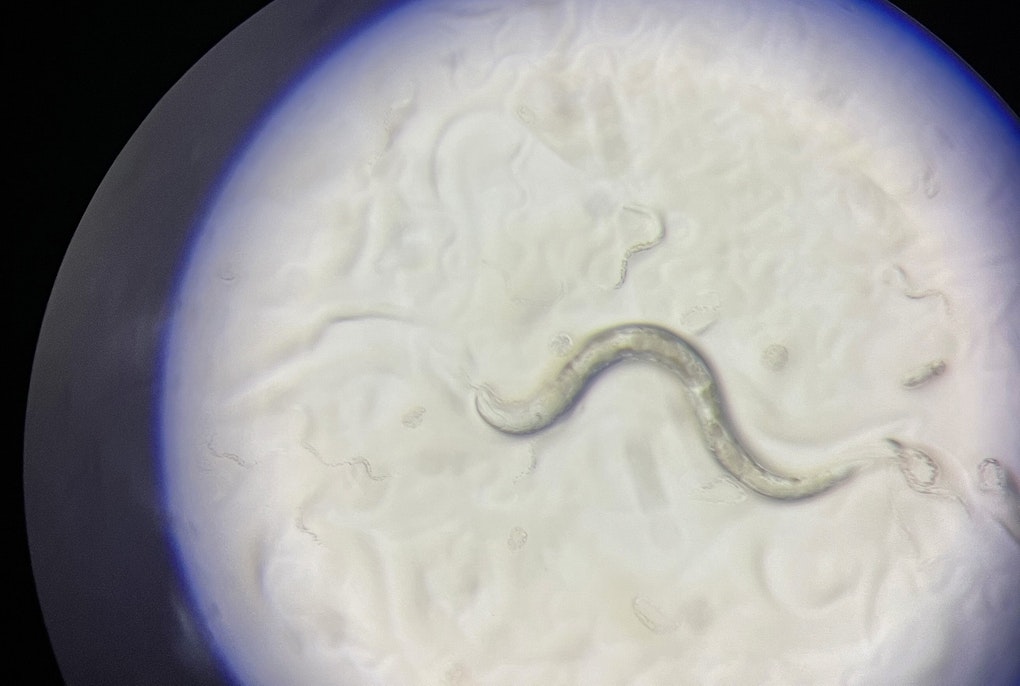
Si parte da un campione di sangue o di pelle. Da lì si spogliano le cellule di ogni caratteristica e si ottengono cellule staminali pluripotenti indotte, cioè cellule “neutre”. A quel punto le cellule si “differenziano”, cioè si riprogrammano per ottenere cellule con varie funzioni. Nel nostro caso: neuroni, cioè cellule del cervello. © Eurac Research | Fabio Dalvit
Queste sono immagini prese dal microscopio: sono neuroni ottenuti in laboratorio da cellule staminali pluripotenti indotte. Per poter vedere meglio i mitocondri, cioè le parti che forniscono energia, e studiare il loro ruolo nella malattia di Parkinson, le componenti della cellula vengono “colorate” in modo diverso usando dei reagenti chimici.
In blu i nuclei, in verde i mitocondri e in rosso la proteina mitocondriale SLP-2
I mitocondri non sono elementi immobili dentro alle cellule; anzi, continuano a fondersi e dividersi. Questo è un timelapse che copre quattro ore.
Gene LRRK2 e corpi di Lewy
Le cellule umane digeriscono parti di sé stesse per liberarsi di scarti o quando sono a corto di sostanze nutrienti. Questo meccanismo si chiama autofagia; è lo stesso fenomeno per cui “bruciamo grassi” quando digiuniamo.
Nei malati di Parkinson con una mutazione del gene LRRK2 l’autofagia non funziona così bene. Nei loro neuroni si formano così degli accumuli della proteina alfa-sinucleina che intossicano le cellule (l'alfa-sinucleina è la proteina di cui sono composti i corpi di Lewy).
I ricercatori di Eurac Research, in collaborazione con il team di Martin Lévesque dell’Università Laval (Canada), sono intervenuti su modelli di cellule per modificare l’azione del gene LRRK2 e ripristinare così l’autofagia; hanno verificato che i corpi di Lewy effettivamente si riducono. Secondo i ricercatori, questa è una nuova, promettente strategia per contrastare la malattia.
L’immunofluorescenza è una tecnica sofisticata che permette di studiare meglio quello che succede dentro alle cellule. Queste immagini mostrano modelli cellulari e neuronali. Il nostro team di ricerca osserva grazie a queste immagini come comunicano (o non comunicano) tra loro i neuroni e come eliminano le scorie.
Gene LRRK2 e comunicazioni tra neuroni
Dove comincia la malattia di Parkinson? Secondo gli studi più recenti le primissime alterazioni riguardano la comunicazione tra i neuroni. In Eurac Research un filone di ricerca riguarda proprio le comunicazioni: le neurotrasmissioni sinaptiche che sono la parte terminale degli assoni, cioè i binari che consentono ai neuroni di collegarsi con le varie parti del cervello e portare informazioni e istruzioni.
Struttura microtubolare
Si chiama così la struttura fatta di proteine che “tiene insieme” i neuroni. In collaborazione con l’Università di Milano, un team di Eurac Research studia queste ossature e cerca di capire se e come gli accumuli di alfa-sinucleina danneggino anche queste strutture.
Quanti fondi vengono investiti nella ricerca sul Parkinson, a livello pubblico e privato?
I fondi destinati alla malattia di Parkinson non sono molti, in rapporto ad altre malattie. Per esempio nel 2019 il Dipartimento per la salute degli Stati Uniti ha investito nella ricerca sul Parkinson circa 240 milioni di dollari, a fronte di oltre un miliardo e mezzo destinati alla ricerca sull’Alzheimer. La ricerca sulle malattie neurodegenerative sta attraversando una fase delicata, dopo che grosse aziende si sono un po' ritirate. Lo hanno fatto perché è difficile testare terapie neuroprotettive: costa molto e il rischio che “cadano” già in fase di sperimentazione clinica e non vengano mai commercializzate è altissimo.
Ci sono enti privati che finanziano in modo specifico la ricerca sul Parkinson, come la Fondazione Michael J. Fox e la Fondazione Parkinson Disease negli Stati Uniti, Parkinson’s UK, l’associazione Parkinson Canada e il Weston Brain Institute in Canada, e in misura minore la Fondazione Fritz Thyssen in Germania e Telethon in Italia.
A livello di agenzie governative o pubbliche i vari gruppi di ricerca devono conquistarsi i fondi destinati alla ricerca in generale. L’Alto Adige, in particolare, ha programmi di partenariato con le agenzie governative tedesca, austriaca e svizzera, e con l’Euregio Science Fund. Nel lavoro di chi fa ricerca, trovare i fondi e preparare richieste competitive è sicuramente una parte fondamentale e che impegna molto tempo ed energie.
Le grosse aziende si sono un po’ ritirate dalla ricerca: costa molto e il rischio che non si arrivi a terapie commercializzabili è troppo alto
Quali sono i centri di riferimento per l’assistenza in Alto Adige?
Oltre agli ambulatori ospedalieri che fanno capo alla neurologia, l’Associazione altoatesina per il Parkinson e malattie affini raccoglie anche diversi gruppi di auto-aiuto.
eurac e+learning

Il Parkinson è una malattia neurodegenerativa più frequente tra gli ultrasessantenni. Questo corso e-learning fornisce un'introduzione a ciò che accade nel cervello delle persone con Parkinson, spiega come viene diagnosticata la malattia e presenta lo stato dell'arte della ricerca.
 Science that inspires
Science that inspiresPubblicazioni scientifiche
Una lista aggiornata delle pubblicazioni scientifiche di Eurac Research su questo tema è disponibile nell'Archivio Istituzionale di Bolzano BIA. Profili personali ORCID di Irene Pichler e Mattia Volta.
Colophon
Testi: Irene Pichler e Mattia Volta, ricercatori dell’Istituto di biomedicina di Eurac Research
Supporto scientifico: Alessandra Zanon
Redazione: Valentina Bergonzi
Illustrazioni: Oscar Diodoro
Videoanimazioni: Fabio Dalvit
Redazione immagini: Annelie Bortolotti, Thomas Iacopino, Matthias Mühlberger
Grafica: Elisabeth Aster