magazine_ Article
Den Geheimnissen von Parkinson auf der Spur
Wie Neurowissenschaft und Genforschung neue Erkenntnisse über gestörte Zellfunktionen gewinnen
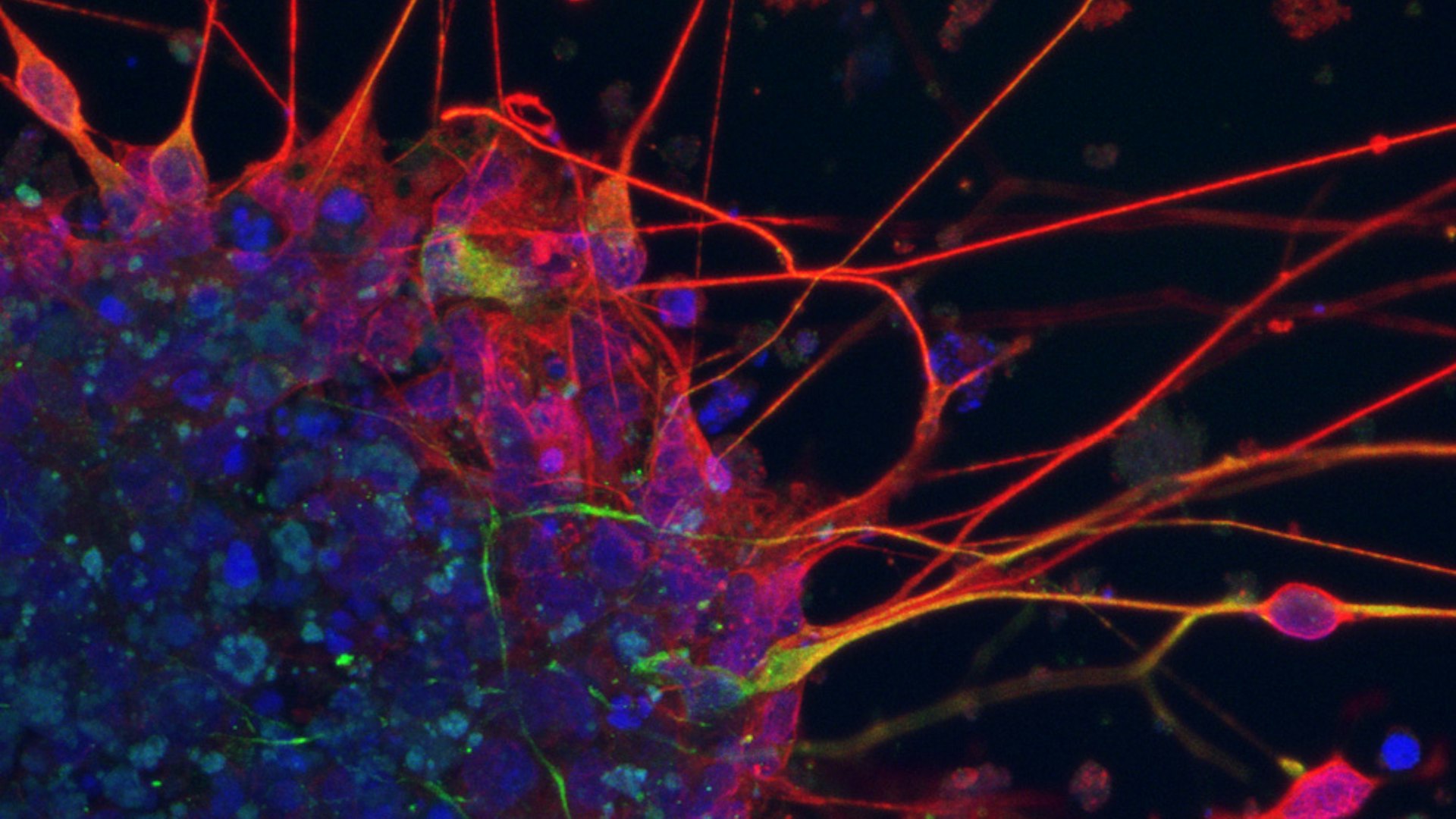
Dopamin-produzierende Neuronen, differenziert aus induzierten pluripotenten Stammzellen. In Blau die Zellkerne, in Rot und Grün zwei Marker, die anzeigen, dass es sich tatsächlich um dopaminerge Neuronen handelt.
Photo: Alessandra Zanon | Eurac Research
1817 beschrieb der englische Arzt James Parkinson zum ersten Mal die Symptome eines mysteriösen Leidens, das er „Schüttellähmung“ nannte und das schließlich seinen Namen erhielt. Mehr als 200 Jahre später gibt die Krankheit der Wissenschaft noch immer viele Rätsel auf. Doch nach und nach gelingt es, sie zu entschlüsseln.
Die Kranken zeigten „unwillkürliche, zitternde Bewegungen, verbunden mit verminderter Muskelkraft“ schrieb der Londoner Arzt James Parkinson 1817 in seiner „Abhandlung über die Schüttellähmung“, und zum fortgeschrittenen Stadium des Leidens stellte er fest: „Selbst in den einfachsten Verrichtungen des Alltags gehorchen die Glieder dem Willen nicht.“ Parkinson hatte nicht viele Patienten beobachtet, beschrieb einige ihrer Symptome aber sehr treffend. Über den Ursprung der Krankheit konnte er nur spekulieren – seiner Vermutung nach lag er in der Halswirbelsäule. Heute weiß die Medizin es besser: Die Krankheit geht von einem kleinen Teil des Mittelhirns aus, der substantia nigra, deren Nervenzellen den neuronalen Botenstoff Dopamin produzieren. Bei Parkinson-Kranken sterben diese Nervenzellen ab – mit drastischen Folgen, denn Dopamin spielt für die Bewegungssteuerung eine wichtige Rolle. Weshalb die Nervenzellen vorzeitig altern und schließlich sterben, ist undurchsichtig. Die meisten Parkinson-Fälle werden als „idiopathisch“ eingestuft, was bedeutet, dass keine Ursache erkennbar ist. Nur zehn Prozent der Kranken haben ihr Schicksal geerbt; etwa 20 Gene, die mit der Entstehung der Krankheit in Zusammenhang stehen, sind inzwischen identifiziert. Doch obwohl die Genmutationen von Parkinson zahlenmäßig keine besonders große Bedeutung haben, war es gerade ihre Erforschung, die in den letzten zwanzig Jahren die größten Fortschritte für das Verständnis der Krankheit brachte. „Dank neuer, bahnbrechender Technologien haben wir wirklich Einblick in die Vorgänge in der Zelle“, erklärt Peter P. Pramstaller, Leiter des Instituts für Biomedizin von Eurac Research. „Was in der Tumorbiologie schon früher passierte, das geschieht jetzt auch in der Hirnforschung. Und die Genetik ist dabei zentral.“
Zu verstehen, was genau in den Nervenzellen passiert, ist der erste Schritt. Die interessante Frage ist dann: Kann ich diesen Prozess verlangsamen oder sogar aufhalten?
Peter Pramstaller
Indem Wissenschaftler nämlich untersuchen, was ein mutiertes Gen in den Nervenzellen bewirkt, erkennen sie entscheidende molekularbiologische Zusammenhänge – und oft genug entdecken sie auch, dass gleiche oder zumindest ganz ähnliche Vorgänge in den Gehirnzellen aller Parkinsonkranken ablaufen. Damit ist zwar die letzte Ursache des Leidens noch nicht geklärt; aber wenn es gelingt, Mechanismen zu entschlüsseln, die den verschiedensten Parkinson-Formen gemeinsam sind, dann kann es irgendwann auch möglich sein, für die verschiedensten Krankheitsformen gemeinsame Biomarker oder Therapien zu finden.
„Zu verstehen, was genau in den Nervenzellen passiert, ist nur der erste Schritt“, erklärt Pramstaller. „Die interessante Frage ist dann: Kann ich in diesen Prozess eingreifen? Ihn verlangsamen – oder vielleicht sogar aufhalten?“ Pramstaller beschäftigt sich mit Parkinson, seit er Mitte der neunziger Jahre als junger Neurologe für einen längeren Forschungsaufenthalt am Londoner National Hospital of Neurology and Neurosurgery war und dort mit David Marsden, einer Koryphäe des Fachs, zusammenarbeiten durfte. Zu jener Zeit begannen Wissenschaftler gerade damit, die Gene hinter den erblichen Formen von Parkinson aufzuspüren. Unter den ersten, die entdeckt wurden, war Parkin: Veränderungen in diesem Gen spielen besonders bei Parkinson mit frühem Krankheitsbeginn eine wichtige Rolle.
Zurück in Bozen baute Pramstaller die Parkinson-Ambulanz am Krankenhaus Bozen auf und startete außerdem mit Hausärzten und Neurologen eine große Studie zur Häufigkeit und Verteilung von Parkinson in Südtirol. Die Verbindung von Forschung und klinischer Praxis erwies sich als fruchtbar: So stießen Pramstaller und seine Mitarbeiter etwa auf Familien, in denen mehrere Mitglieder von der Krankheit betroffen waren, weil ihr Parkin-Gen mutiert war. Die Forscher untersuchten die in Südtirol gewonnenen Daten in Zusammenarbeit mit internationalen Kollegen, wobei sie wichtige neue Aspekte der Krankheit erhellten; zum Beispiel zeigte sich, dass die durch Parkinmutation bedingte Erkrankung in ihrem Erscheinungsbild den idiopathischen Krankheitsformen oft ähnlicher ist, als man angenommen hatte.
Die Zellen, die Dopamin produzieren, sind sehr stressempfindlich und brauchen viel Energie. Arbeiten die Mitochondrien nicht richtig, fehlt diese Energie – das könnte zum Zelltod beitragen.
Irene Pichler
Als besonders vielversprechend erwies sich zuletzt eine Spur, der die Forscherinnen Irene Pichler und Alessandra Zanon am Institut für Biomedizin nachgingen. Im Mittelpunkt steht dabei das Zusammenspiel von Parkin mit den Mitochondrien, den Zellkraftwerken. Mehrere internationale Studien haben gezeigt, dass intaktes Parkin unter Stressbedingungen wesentlich zur Gesundheit der Mitochondrien beiträgt und so die Nervenzellen vor dem Zelltod schützt. Ist das Parkin-Gen dagegen in seiner Funktion eingeschränkt, beeinträchtigt dies auch die Mitochondrien. Dieser Zusammenhang liefert möglicherweise eine Erklärung für das Absterben der Nervenzellen, wie Irene Pichler erläutert: „Die Zellen, die Dopamin produzieren, sind sehr stressempfindlich und brauchen viel Energie. Arbeiten die Mitochondrien nicht richtig, fehlt diese Energie – das könnte zum Zelltod beitragen.“ Pichler und Zanon wollten genauer erforschen, was zwischen Parkin und den Mitochondrien in den Nervenzellen passiert: Systematisch suchten sie nach mitochondrialen Proteinen, die mit Parkin zusammenarbeiten, um die Funktion der Mitochondrien zu erhalten. Gemeinsam mit Forschern aus Lübeck und Kalifornien entdeckten sie schließlich, dass der zentrale Interaktionspartner ein Protein namens SLP-2 ist, das offenbar sogar Defizite von Parkin ausgleichen kann: Erhöhten die Forscher die Konzentration von SLP-2 in Zellen mit defektem Parkin, schien das Protein fragmentierte Mitochondrien richtiggehend zu heilen.
Dass solche Untersuchungen heute möglich sind, ist ein Beispiel für den rasanten technologischen Fortschritt in der Biomedizin. Die Forscher sind heute in der Lage, aus Haut- und Blutzellen von Patienten im Labor künstlich Nervenzellen herzustellen – sozusagen Duplikate der kranken Zellen im Gehirn. Was die Forscherinnen in Bozen an solchen Zellmodellen zeigten, testeten dann Kollegen in Kalifornien an Fruchtfliegen: Der erstaunliche Effekt des Proteins erwies sich auch hier. Mittlerweile weiß man, dass beinah alle bekannten Gene, die mit der Entstehung der Krankheit in Zusammenhang stehen, einen Einfluss auf verschiedene Aspekte der Mitochondrienfunktion haben. Die Wissenschaftsgemeinschaft arbeitet deshalb auch an verschiedensten Möglichkeiten, die Mitochondrienfunktion bei Parkinson zu verbessern. Zahlreiche klinische Studien sind im Gange, einige davon vielversprechend. Neben Parkin sind zum Beispiel PINK1 und Alpha-Synuclein zwei weitere Gene, die, wenn sie Mutationen aufweisen, Parkinson verursachen; für beide konnte in zahlreichen Studien eine Beeinträchtigung der Mitochondrienfunktion gezeigt werden konnte. Auch diese Genmutationen erforschen die Wissenschaftlerinnen von Eurac Research, indem sie Zellmodelle anlegen und die Mitochondrienfunktion untersuchen. Internationale Kooperationen und Finanzierungen spielen dabei eine wichtige Rolle. Zusammen mit Forschungspartnern aus Kalifornien und Kananda konnten bereits erste Ergebnisse gesammelt werden, die darauf hindeuten, dass SLP-2 auch bei anderen seltenen Formen der Erkrankung einen Nutzen bringen und möglicherweise die dopaminergen Neuronen schützen kann.