magazine_ Interview
Il mio nome è elegans, C. elegans
Come un minuscolo verme che si contorce sta permettendo di scoprire i meccanismi della malattia di Parkinson.
Il verme nematode Caenorhabditis elegans è un importante modello animale in diversi studi biomedici. Esaminiamo il ruolo che può svolgere nella comprensione della malattia di Parkinson.
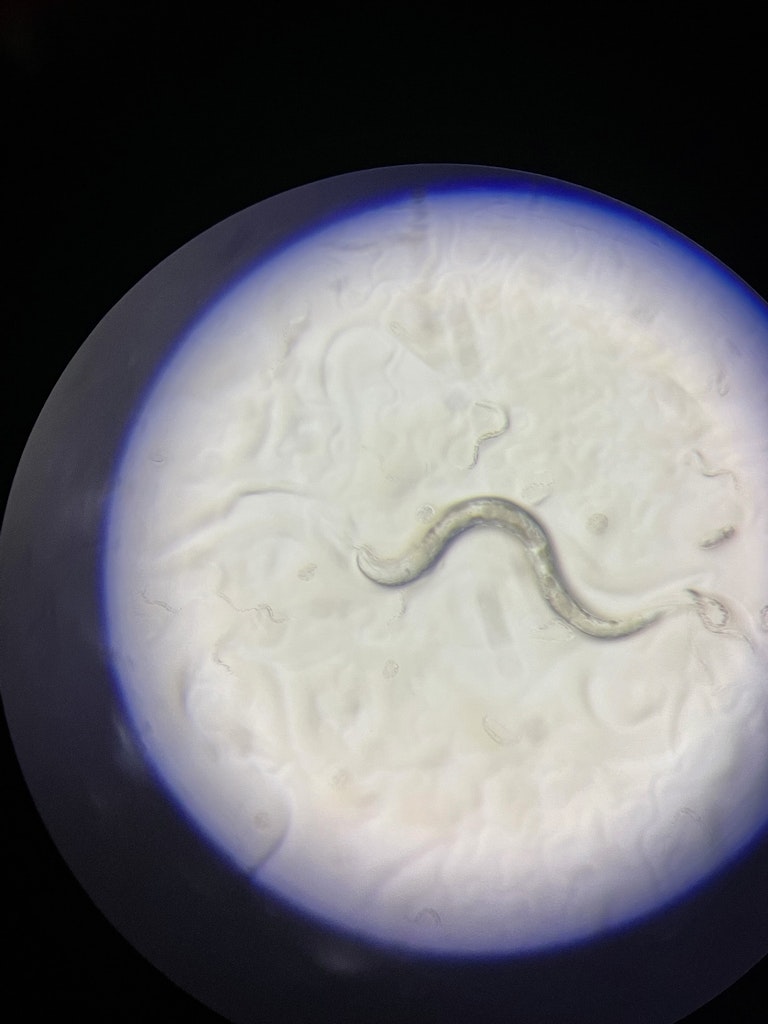
I vermi trasparenti, noti anche come nematodi, sono ovunque. Si tratta per lo più di microscopici vermi cilindrici che si sono adattati a una spettacolare gamma di ambienti, dal suolo antartico all’interno dell’intestino. Sono presenti in così tanti microambienti che il nematologo Nathan Cobb una volta ha predetto: “Se tutta la materia dell’universo, tranne i nematodi, fosse spazzata via, il nostro mondo sarebbe ancora riconoscibile”. Di recente i vermi nematodi hanno fatto notizia: dalla scoperta di un nematode di 46.000 anni fa rinchiuso nel permafrost siberiano e riportato in vita, al fungo carnivoro dell’ostrica che si nutre di nematodi iniettando loro un gas nervino. Non c’è da sorprendersi se, essendo una delle specie più prolifiche del nostro pianeta, la pelle del lamantino della Florida ne ospiti circa mezzo milione.
C. elegans è solo una delle specie, ma, come leggerete, molto interessante e importante. Misura appena un millimetro dalla testa alla coda, di solito vive nel terreno e si nutre di batteri e altri microrganismi. La maggior parte degli adulti sono ermafroditi, con uova e sperma, e producono diverse centinaia di figli attraverso l’autofecondazione. Un nematode può produrre 1000 figli. In una settimana.
Roman Vozdek è un biochimico, ingegnere biomedico e primo e unico nematologo dell’Istituto di biomedicina di Eurac Research. Dopo aver creato il primo laboratorio di C. elegans di Bolzano, parliamo con lui di come queste meraviglie microscopiche possano aiutare a comprendere i meccanismi della malattia di Parkinson.
Qual è la sua giornata tipo?
Roman Vozdek: La prima cosa che faccio di solito quando arrivo in laboratorio è controllare le piastre che mi interessano. Se ho incrociato i vermi due giorni prima, controllo se si sono incrociati o meno. A volte non lo fanno. Quindi, se non lo fanno, devo organizzare di nuovo l’accoppiamento.
Con candele e musica romantica?
Roman:(Ride). In realtà ascoltano spesso i Pearl Jam. Comunque, per l’incrocio mi bastano i maschi di una varietà. Li metto sulla piastra con l’ermafrodito di un’altra varietà e poi controllo se c’è una progenie dei due genotipi originali. Di solito verifico il genotipo di questi vermi facendo una PCR (reazione a catena della polimerasi), altre volte svolgo un esame al microscopio in modo relativamente veloce. Poi guardo le altre piastre. Se sto facendo degli esperimenti, controllo come stanno andando e se si sta manifestando il fenotipo che mi aspettavo. Uso anche alcune tecniche biochimiche per indagare le funzioni dei geni. In pratica passo tutto il giorno in laboratorio a fare ciò che deve essere fatto.
E registra quello che vede?
Roman: Fotografo il verme e registro video del suo comportamento. I vermi si comportano in modo diverso a seconda delle condizioni. Si può studiare la velocità con cui strisciano e come rispondono allo stress. I fattori di stress possono essere manipolati chimicamente, meccanicamente o con la temperatura. Si può vedere se i vermi hanno il fenotipo del foraggiamento o se non hanno la capacità di trovare cibo. Si può analizzare come nuotano e come rispondono ai liquidi. Sebbene ogni verme sia molto piccolo, è abbastanza spesso da poter essere fotografato in dettaglio. A volte, quando si fotografa l’intero organismo, non si riescono a vedere i dettagli di ciascun tessuto. Il verme è un organismo completo con muscoli, neuroni, ipoderma, etc. È possibile ottenerne un’immagine dettagliata con una tecnica chiamata microscopia confocale: si prendono le scansioni dei tessuti e si costruisce un’immagine tridimensionale. Tutto questo viene fatto quando il verme è immobilizzato, perché altrimenti striscia dappertutto. L’importante è che sia vivo. Quindi, grazie a C. elegans possiamo studiare la biologia in-vivo, cioè lo studio di qualcosa in un organismo vivente.
C. elegans: in-vivo
Video: Annelie Bortolotti | Eurac Research
Come si ottengono questi vermi? Da dove provengono?
Roman: Vivono nella maggior parte dei terreni e si trovano in tutti i continenti. Basta guardarli al microscopio per vederli. Il C. elegans più famoso è stato isolato a Bristol, nel Regno Unito, ed è il tipo selvatico, il ceppo selvatico originale di C. elegans, che viene utilizzato come ceppo di riferimento in tutti i laboratori di ricerca che lo studiano. Ma ora sappiamo che ci sono miriadi di ceppi selvatici perché è possibile isolare questi vermi ovunque nel mondo. Una comunità di studiosi dei vermi ha creato una banca di C. elegans che raccoglie i vermi generati nei diversi laboratori del mondo e li distribuisce se c'è interesse. È anche possibile condividere i ceppi direttamente con altri laboratori. La comunità di scienziati che studia i vermi è molto generosa e amichevole. Quindi, per ottenere i vermi da questi laboratori o da una banca, è sufficiente lavorare in un laboratorio certificato C. elegans. Quando ho iniziato a lavorare con i vermi, il prezzo era di 7 dollari per un ceppo, ora è di circa 10 dollari. Ti mandano delle piastre di Petri con centinaia di vermi perché devono sopravvivere alla spedizione: di solito sono in viaggio per settimane perché si bloccano alla dogana. Ma per i vermi non è un problema, perché possono vivere mesi senza cibo. In un ceppo tutti i vermi sono identici e hanno un genotipo definito: il DNA è lo stesso in ogni individuo. Negli ultimi quattro anni ho già ordinato più di 100 ceppi diversi e ne ho prodotti più di 300 da solo.
Come si inserisce il gene del Parkinson nel verme?
Roman: Nel nostro caso ho utilizzato un gene umano che codifica una proteina chiamata alfa-sinucleina, che quando si aggrega diventa tossica per i neuroni ed è anche associata a forme familiari di Parkinson. Ho inserito questo gene umano tra i frammenti di DNA di C. elegans che assicurano che il gene sarà attivo solo in specifici neuroni. Possiamo iniettare il DNA nella gonade del verme, le cui uova lo assumeranno come proprio. I vermi portatori di questo gene umano soffrono di neurodegenerazione, ma non presentano i classici sintomi del Parkinson, come i tremori, perché questo è legato alla biologia umana.
E perché proprio nei vermi?
Roman: Tutto è iniziato a Praga. Durante il mio dottorato mi sono concentrato sul ruolo di alcuni geni di C. elegans nel metabolismo dell’idrogeno solforato. Abbiamo scoperto funzioni davvero interessanti e inaspettate di questi geni e mi sono reso conto di quanto il verme sia interessante per la ricerca e ho voluto continuare a studiare la biologia del C. elegans. Una volta terminato il dottorato, mi sono trasferito negli Stati Uniti dove ho lavorato a uno studio con vermi veri e propri, non solo con il loro DNA o le loro proteine. Stavamo lavorando su una proteina che salva, o meglio, promuove la sopravvivenza dei neuroni dopaminergici in coltura. I neuroni dopaminergici sono quelli che muoiono quando si ha il morbo di Parkinson. Usavamo C. elegans e stavamo lavorando su come questa proteina salvasse davvero i neuroni e ho iniziato a interessarmi alla neurodegenerazione. Ho contattato Andrew Hicks, vicedirettore dell’Istituto di biomedicina, che lavorava con le cellule di pazienti reali, per sapere se fosse interessato a usare i vermi per capire meglio la patologia. C. elegans offre un modello vivente complesso per studiare la biologia di base dei geni associati alla malattia di Parkinson. Si scopre cosa fanno questi geni in modo semplice, facile e poco costoso. Poi si può esaminare la biologia umana. È la stessa o no? Gran parte della biologia presente nei vermi è presente anche nell’uomo.
Ho sentito che è stato riportato in vita un verme dopo 46.000 anni di permanenza nel permafrost, un nematode.
Roman: Già. Questo è un altro grande vantaggio. È possibile congelarli, come facciamo regolarmente con i batteri. Con i vermi si può fare lo stesso, è un grande vantaggio di questo modello. Si possono congelare e prelevare dopo diversi anni e sono ancora vivi.
Può spiegare il contesto a chi non è del mestiere? Qual è l’obiettivo finale di questo progetto specifico?
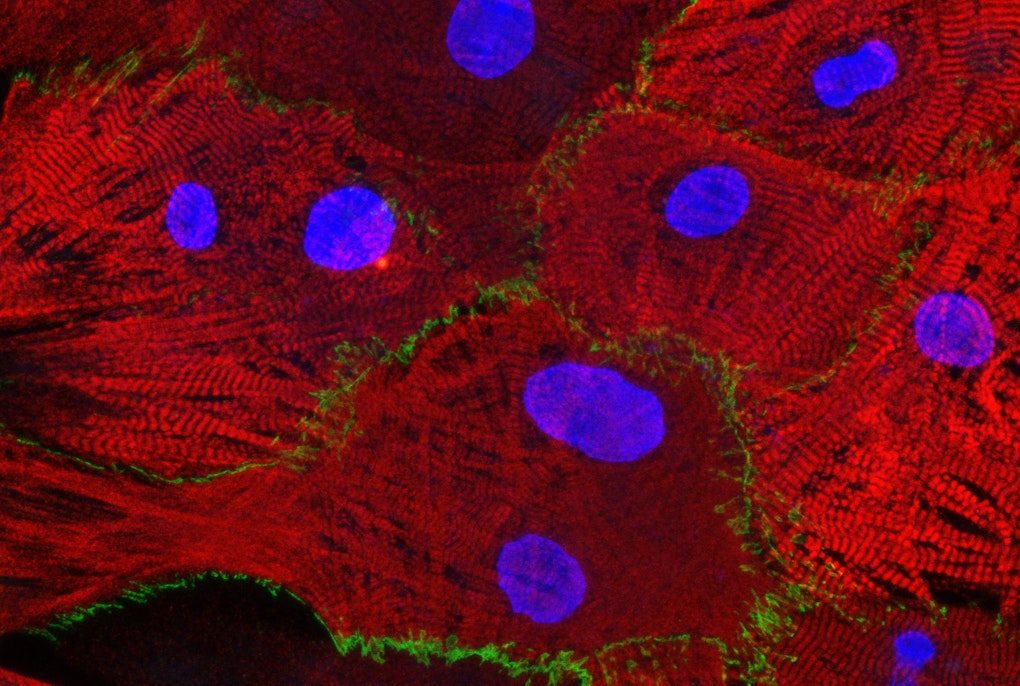
Roman: Il segno distintivo patologico della malattia di Parkinson sono i corpi di Lewy, accumuli anomali di proteine che si sviluppano nel cervello e che contengono una proteina aggregata chiamata alfa-sinucleina. Come ho detto prima, quando il gene dell’alfa-sinucleina si trova nel verme e viene attivato nei neuroni, questi ultimi degenerano. Abbiamo quindi pensato che utilizzando un modello della malattia di Parkinson su un verme, con neuroni degenerati che sintetizzano la dopamina, avremmo potuto studiare il ruolo di diversi geni o l’effetto di diversi metaboliti e sostanze chimiche sulla neurodegenerazione. In questo modo si potrebbero scoprire meccanismi neuroprotettivi fondamentali che sono evolutivamente conservati anche nell’uomo. Tuttavia, non esisteva alcun ceppo in nessuna delle banche o laboratori in cui si potesse monitorare il modo in cui questa proteina si aggregasse o dove venisse espressa all’interno del neurone. Ho quindi creato un verme con un tag fluorescente sull’alfa-sinucleina. Uso i colori, il verde per visualizzare la sinucleina, in modo da poter vedere cosa fa, dove si aggrega nel neurone, dove è espressa, in quali condizioni non si aggrega, etc. E in rosso marco i neuroni veri e propri per mostrare esattamente dove si trova il neurone e qual è la sua morfologia. Questo ceppo è diventato molto popolare e viene utilizzato in diversi laboratori in tutto il mondo. In questo modo è possibile visualizzare organelli, cellule, interi tessuti. È possibile visualizzare le proteine e scendere nei dettagli grazie a questi tag fluorescenti. A proposito, la proteina verde fluorescente è in realtà un gene di medusa. Nel nostro laboratorio, utilizzo diversi modelli di C. elegans per il Parkinson, come quello che ho citato, e studio il ruolo di diversi geni associati alla malattia in questi modelli di vermi. Abbiamo identificato alcuni geni che sono neuroprotettivi o neurotossici e quindi, con i colleghi dell’Istituto, dovremo seguire e valutare il ruolo di questi geni in modelli cellulari umani per vedere quali di questi geni avranno un potenziale come bersagli terapeutici per la malattia di Parkinson.
I nematodi e il premio Nobel
Nel 2002 John Sulston, Sydney Brenner e Bob Horvitz hanno vinto il premio Nobel per la fisiologia e la medicina “per le loro scoperte sulla regolazione genetica dello sviluppo degli organi e della morte cellulare programmata”, ovvero su come i geni regolano lo sviluppo e la morte delle cellule. Gli studi sul verme nematode Caenorhabditis elegans hanno portato a una rivalutazione dell’importanza dei geni coinvolti nell’eliminazione deliberata di alcune cellule durante il normale sviluppo. Per studiare questi meccanismi, Sydney Brenner ha studiato il verme nematode trasparente per capire come i geni controllino lo sviluppo a partire da un uovo fecondato. In una serie di pubblicazioni scientifiche, il team ha mappato il lignaggio di ogni cellula del nematode e ha descritto le fasi visibili della morte cellulare programmata, dimostrando le prime mutazioni genetiche coinvolte nel processo e identificando i primi due veri e propri “geni della morte”: ced-3 e ced-4, che sono presenti anche nel genoma umano.
Alcuni organismi, come le meduse, “brillano” perché emettono una luce scintillante che è stata chiamata Green Fluorescent Protein (GFP). Nel 2008 anche Martin Chalfie ha ricevuto l’ambito premio per le scoperte che gli hanno permesso di inserire il gene GFP nella C. elegans, riuscendo così a “colorare” sei singole cellule che potevano poi essere tracciate.
Perché C. elegans?
Il Caenorhabditis elegans è il soggetto perfetto per studiare come si possa generare un organismo completo a partire dal codice genetico del DNA. Ogni verme maturo ha esattamente 959 cellule e, grazie al rapido sviluppo dall’uovo all’adulto che può essere facilmente osservato al microscopio, è possibile studiare un ciclo di vita completo mappando ciò che accade a ogni cellula del nematode durante lo sviluppo. Questo nematode può trasformarsi da uovo ad adulto in soli tre giorni. Agli scienziati piace il nematode perché può essere facilmente tenuto in laboratorio, si nutre volentieri di batteri che crescono in una piastra di Petri e ha una forma del corpo straordinariamente semplice. Questa semplicità aiuta a capire come un organismo pluricellulare venga creato a partire da informazioni genetiche codificate in una molecola di DNA.
About the Interviewed
Roman Vozdek, biochimico e ingegnere biomedico, ha acquisito esperienza nei laboratori di ricerca sui nematodi C. elegans del Massachusetts Institute of Technology (MIT) e della University of California San Francisco (UCSF). Utilizza questi vermi rotondi per trovare nuovi bersagli terapeutici per il trattamento delle malattie associate allo stress ossidativo, tra cui la malattia di Parkinson. Dopo aver conseguito un master in biochimica e biomedicina, il suo dottorato di ricerca e il suo lavoro post-dottorato hanno identificato le vie genetiche e i meccanismi molecolari che promuovono l’adattamento cellulare all’ipossia e allo stress ossidativo in C. elegans. Ha ottenuto numerosi finanziamenti e borse di studio e ha pubblicato su Nature communication, Science signaling, Frontiers in Aging Neuroscience. Ha fondato il laboratorio C. elegans all’Istituto di biomedicina di Eurac Research per sfruttare la genetica del verme come potente strumento di scoperta per identificare nuovi meccanismi di neurodegenerazione. Il suo progetto, STANIMON è stato finanziato dalla borsa di mobilità internazionale della Provincia Autonoma di Bolzano - CUP D55F21004130003.